Um dos fatores limitantes ao desenvolvimento das culturas é a acidez do solo. Os solos brasileiros são, em geral, solos ácidos e com baixa disponibilidade de nutrientes necessários ao maior rendimento das lavouras. Portanto, uma prática, que ser torna necessária, é a correção desta acidez criando condições melhores tanto na fertilidade do solo como nas plantas. O alumínio (Al) e o manganês (Mn) são tóxicos devido a maior solubilidade nos solos ácidos. A acidez diminui a população de microorganismos que são responsáveis pela decomposição da matéria orgânica.
Nas leguminosas, a fixação simbiótica é reduzida em solos com pH menor que 6,5. Além disto, nos solos ácidos, a capacidade de troca de cátions (CTC) é baixa; o cálcio (Ca) e o magnésio (Mg) são limitantes, bem como, a disponibilidade de fósforo (P) e molibdênio (Mo). A acidez é medida pelo H+dissociado na solução do solo, expressa em pH. Quanto mais baixo for o pH do solo, maior a quantidade de H+.
A acidificação do solo ocorre de várias maneiras: Nas leguminosas, a fixação simbiótica é reduzida em solos com pH menor que 6,5. Além disto, nos solos ácidos, a capacidade de troca de cátions (CTC) é baixa; o cálcio (Ca) e o magnésio (Mg) são limitantes, bem como, a disponibilidade de fósforo (P) e molibdênio (Mo). A acidez é medida pelo H+dissociado na solução do solo, expressa em pH. Quanto mais baixo for o pH do solo, maior a quantidade de H+.
1) dissociação do gás carbônico que está presente no solo;
O H+ vai para a fase sólida do solo e libera um cátion trocável que é lixiviado com o HCO3-;
2) reação dos fertilizantes quando aplicados no solo, como o caso dos amoniacais NH4) e da uréia CO(NH2)2 que liberam H+ ;
Aqui o NH4 vai reagir com o solo liberando H+ que, por sua vez, libera um cátion trocável para a solução do solo; este cátion liberado será lixiviado aumentando a acidificação do solo;
3) hidrólise do Al³+ que libera H+; A reação é a seguinte:
4) decomposição da matéria orgânica;
Na sua decomposição, a matéria orgânica, sob ação de bactérias, libera amônia (NH3) que se converte em nitrato liberando H+, aumentando a acidez;
5) água das chuvas;
Pela ação das chuvas, a água lixivia o Ca e o Mg. Com isto, há uma substituição por Al, Mn e H na solução do solo;
6) erosão do solo; Os solos que sofrem erosão podem se tornar mais ácidos;
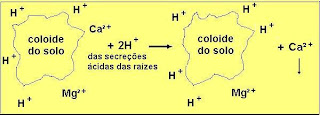
7) secreções ácidas das raízes das plantas.
As secreções ácidas das raízes libera H+ que substitui o cátion adsorvido ao coloide do solo; o cátion (na figura abaixo representado pelo Ca²+) pode ser absorvido pelas raízes ou lixiviado.
A acidez do solo se divide em ATIVA e POTENCIAL.
Acidez ativa: são os íons H+ da solução do solo em concentrações baixas quando comparados com os íons H+ adsorvidos. É expressa pelo valor do pH do solo. O pH é determinado em água: usa-se uma relação solo:água de 1:2,5. Mede-se o pH através da imersão de um elétrodo de vidro ligando a um potenciômetro. Podem ser usadas, também, soluções salinas, como o KCl e CaCl2.
A acidez potencial divide-se em acidez trocável e não trocável.
A acidez trocável refere-se aos íons Al³+ e H+ retidos na superfície dos coloides do solo. Esta quantidade de H+ trocável é pequena. Como o H+representa menos de 5% da acidez trocável, é admitido apenas o Al³+trocável.
A acidez não trocável é o íon H+ de ligação covalente associado aos coloides em carga negativa e aos compostos de alumínio. É a acidez que os solos apresentam quando em pH menor que 5,5. Acima de pH 5,5 não existe mais Al³+ trocável.
A acidez potencial é a soma da acidez trocável e da acidez não trocável. É ela que limita o crescimento das raízes e ocupa espaços nos coloides possibilitando que os nutrientes livres na solução do solo sejam lixiviados.
As cargas elétricas dos coloides podem ser negativas ou positivas. A acidez potencial é a soma da acidez trocável e da acidez não trocável. É ela que limita o crescimento das raízes e ocupa espaços nos coloides possibilitando que os nutrientes livres na solução do solo sejam lixiviados.
As cargas negativas dos coloides do solo são classificadas em cargas permanentes e cargas dependentes do pH.
As permanentes são cargas que não aumentam ou diminuem com o pH. São oriundas de substituições isomórficas que se verificam no interior da rede cristalina dos argilominerais: as 2:1, expansivas e não expansivas.
As cargas dependentes de pH variam com o pH do solo, aumentando e diminuindo à medida que o pH aumenta ou diminui. Ocorre nos solos com argila 1:1 e com óxidos de ferro e de alumínio, no complexo coloidal.
As cargas positivas dos coloides do solo ocorrem em quantidades menores que as negativas. São responsáveis pela adsorção de ânions. São sempre dependentes do pH, aumentando à medida que ele diminui.
Adsorção e troca de íons.
O processo de adsorção e troca de íons é o resultado da interação entre as fases líquida e sólida dos coloides do solo. É um processo reversível em que os íons da solução do solo são adsorvidos pelos coloides; e, neste processo, deslocam outros íons adsorvidos e de carga elétrica igual. Pela adsorção, os nutrientes permanecem no solo em forma disponível para as plantas; esta retenção é extremamente forte, o que impede que sejam lixiviados. As cargas elétricas dos coloides do solo são responsáveis pela adsorção de íons. Os íons na solução do solo estão em equilíbrio com os íons adsorvidos aos coloides: isto é, a fase líquida está em equilíbrio com a fase sólida. Quando há uma retirada de íons da solução do solo, há uma retirada de íons adsorvidos aos coloides com a finalidade de manter o equilíbrio entre as duas fases.
A Capacidade de Troca de Cátions - CTC - é a medida do poder de adsorção e troca de cátions do solo: é a quantidade de cátions que um solo é capaz de reter por unidade de peso, e é expressa em cmolc/dm³ ou mmolc/dm³. A CTC varia com o pH do solo por causa da existência de um número grande de cargas negativas dependentes de pH, na superfície dos coloides. A CTC efetiva é determinada em função do pH do solo. A CTC potencial é determinada com uma solução tampão a pH 7,0. Nos solos ácidos, a CTC efetiva é inferior à CTC potencial. As CTC's são estimadas pela soma de bases trocáveis, ou seja, os íons adsorvidos, como Ca²+, Mg²+, K+, Na+, H + Al³.
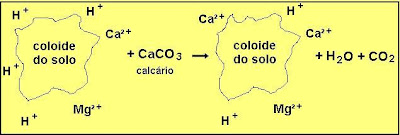
Por que somente estes cátions são levados em consideração quando o solo tem mais outros cátions trocáveis? Porque os outros cátions existentes no solo estão em teores muito pequenos, e, por isto, não são considerados. A CTC varia de solo para solo dependendo do tipo e quantidade de argila, e da matéria orgânica. Para diminuir a acidez do solo não basta, somente, eliminar os íons H+ da solução do solo; é necessário adicionar uma quantidade de corretivo suficiente para corrigir uma porção significativa da acidez potencial e elevar o pH a um nível desejado.
Aqui o íon de Ca²+ do calcário substituiu dois íons de H+; a concentração de íons hidrogênio diminui, e o pH aumenta.
A acidez ativa é apenas uma estimativa da acidez do solo. É preciso conhecer, também, a acidez potencial para uma melhor recomendação de calagem. Faixas de pH entre 4,5-5,8 não constituem problemas para as plantas: o problema é o Al³ trocável, que em pH inferior a 5,5 começa a aparecer a toxidez de alumínio para as plantas. Um solo pode precisar de 2,5 t/ha de calcário enquanto outro solo necessita de 4 t/ha, ambos apresentando o mesmo pH. Para determinar a necessidade de calagem é necessário conhecer a acidez total do solo; isto é, não somente a concentração de H+ na solução do solo (que é a acidez ativa expressa em pH), mas a quantidade de íons H+ que estão ligados às cargas negativas do solo: estes íons servem como acidez de reserva. O corretivo neutraliza o H+da solução do solo; para manter o equilíbrio, um íon de H+ , que estava ligado aos coloides (acidez potencial ou de reserva) é deslocado para a solução do solo repondo o íon H+ neutralizado, e, com isto, mantendo o valor do pH. Para aumentar o pH do solo é preciso esgotar parte dos íons H+ da solução do solo, e aumentar a concentração de íons OH-. Esta resistência na variação do valor do pH é chamada "Poder Tampão do Solo". O poder tampão será tanto maior quanto mais elevado o teor de matéria orgânica, de argilominerais, e de óxidos de ferro e alumínio, que são fontes de Al³ + e H+para a solução do solo. Os solos arenosos, pela pobreza em matéria orgânica, possuem baixo poder tampão.